Research
微生物や動物細胞などがもつ生命現象について、分子レベルでの理解を進め、それを利活用することにより、新たな医薬品開発、有用生体分子生産技術や機能性ナノ材料合成技術の開発を目指します。多種多様な生命が長年培ってきた生体反応を化学的に理解し利活用することができれば、我々人類のより便利な生活を支援できる技術が生み出せると期待しています。現在、特に注目しているのは、細胞分裂や細胞内小胞を生成する際に重要な役割を果たす、細胞膜を変形させるタンパク質の探索技術の開発と機能解析です。さらに、骨や歯に代表される生物による鉱物形成(バイオミネラリゼーション)を模倣できるペプチドを利用した、機能性ナノ粒子の環境調和型合成技術の開発を目指しています。
By advancing our understanding of biological phenomena in microorganisms and animal cells at the molecular level, we aimed to develop new pharmaceuticals, production technologies for useful biomolecules, and synthesis technologies for functional nanomaterials. If we can understand and use biological reactions that have been optimized over years by various organisms, we can create new technologies supporting a more convenient life for all of us. Currently, we are focusing on the development and functional analysis of technologies to identify proteins that deform cell membranes and are implicated in cell division and the generation of intracellular vesicles. Furthermore, we aimed to develop an eco-friendly technology for the synthesis of functional nanoparticles using peptides that can mimic mineral formation (biomineralization) by living organisms, as seen in bones and teeth.
生体膜の曲率認識タンパク質MEMBRANE CURVATURE SENSING PROTEINS
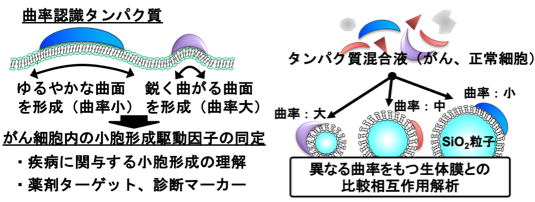
細胞形態と機能発現の相互関係が近年注目されており、細胞機能の発現や疾患の発症過程で、細胞膜構造の様々な変化が確認されます。一方で、細胞内で見られる様々な曲面生体膜の構造制御プロセスにおいて、特定の曲率をもつ曲面生体膜と相互作用し構造を制御する“曲率認識タンパク質”が重要な役割を果たすことが知られています。
我々は現在までに、この曲率認識タンパク質を網羅的に探索できる技術を開発しております。具体的には、下図右に示すコンセプトの通り、サイズ制御された球形SiO2粒子を合成し、これを生体膜で被覆することで異なる曲面生体膜を調製し(SSLB:Spherical Supported Lipid Bilayer)、これに対する混合タンパク質との比較相互作用解析を実施しました。例えば、ヒト乳腺がん細胞株(MDA-MB-231)及びヒト線維芽細胞株(NHDF)それぞれから探索を進め、乳腺がん細胞で特徴的に発現する曲率認識タンパク質を同定しています。また原核生物である大腸菌からも新規曲率認識タンパク質を同定しており、本技術が多種多様なサンプルに適用できる汎用性の高い技術であることが示されております。今後は、この技術をもとに疾病マーカーの探索などを進める予定です。
The relationship between cell morphology and functional expression has garnered considerable scientific attention, and various changes in cell membrane structure have been confirmed during the development of cell function and the onset of diseases including cancer. The membrane structures found in cells are precisely controlled by the constituent lipids and proteins.
Among the plethora of proteins, membrane curvature-sensing (MCS) proteins recognize and regulate the morphology of biological membranes. These proteins preferentially bind to specific membrane curvatures and stabilize their structure via various mechanisms. Towards the agile identification of these proteins, we are developing a technique for the selective identification of MCS proteins based on comparative proteomics analysis using different sizes of the spherical supported lipid bilayer, which consists of spherical SiO2 particles covered with a lipid bilayer.
Using these artificially-prepared membranes exhibiting different curved structures, MCS proteins expressed in human breast cancer (MDA-MB-231) and human fibroblast (NHDF) cell lines were screened. We also identified a novel MCS protein from Escherichia coli. In the future, we will further screen these MCS proteins from various organisms and will determine the relationship between MCS proteins uniquely expressed in disease-related samples for the identification of disease markers based on this technology.
バイオナノミネラリゼーションBIO-NANO MINERALIZATION
室温で金属イオンと混合するだけで、特定の物性をもつ金属ナノ粒子を合成できるバイオミネラリゼーションペプチドの探索を進めています。特に、ペプチドアレイと呼ばれる異なるペプチドを円形スポット状に多数並列合成できる技術を利用することで、合成される粒子の光学的特性を取得しながら候補ペプチド配列を選抜し、多種多様な形態をもつナノ粒子を合成できています。現在は、優れた生体適合性を示し近赤外光を吸収する三角ナノプレートに着目し、これを用いたがんの光熱治療への応用研究を実施しています。さらに、サイズの非常に小さい粒子(2 nm程度)に関しては、新しい触媒としての利用の検討も進めています。
We are investigating biomineralization peptides that can be used to synthesize metal nanoparticles having specific physical properties simply by mixing them with metal ions at room temperature. In particular, by using a technique called peptide arrays, which can synthesize various peptides on a cellulose membrane in parallel, we could select candidate peptide sequences while obtaining the optical property information of the synthesized nanoparticles.
Currently, we are focusing on triangular gold nanoplates exhibiting various potentials, especially for photothermal cancer therapy. We are also investigating the green synthesis of other metallic particles, including magnetic and semiconductor nanoparticles, using various functional peptides. Through further development in this research, we hope to propose a new eco-friendly synthesis method for precisely controlling functional nanoparticles.

ペプチドマトリックスプローブPEPTIDE MATRIX PROBE
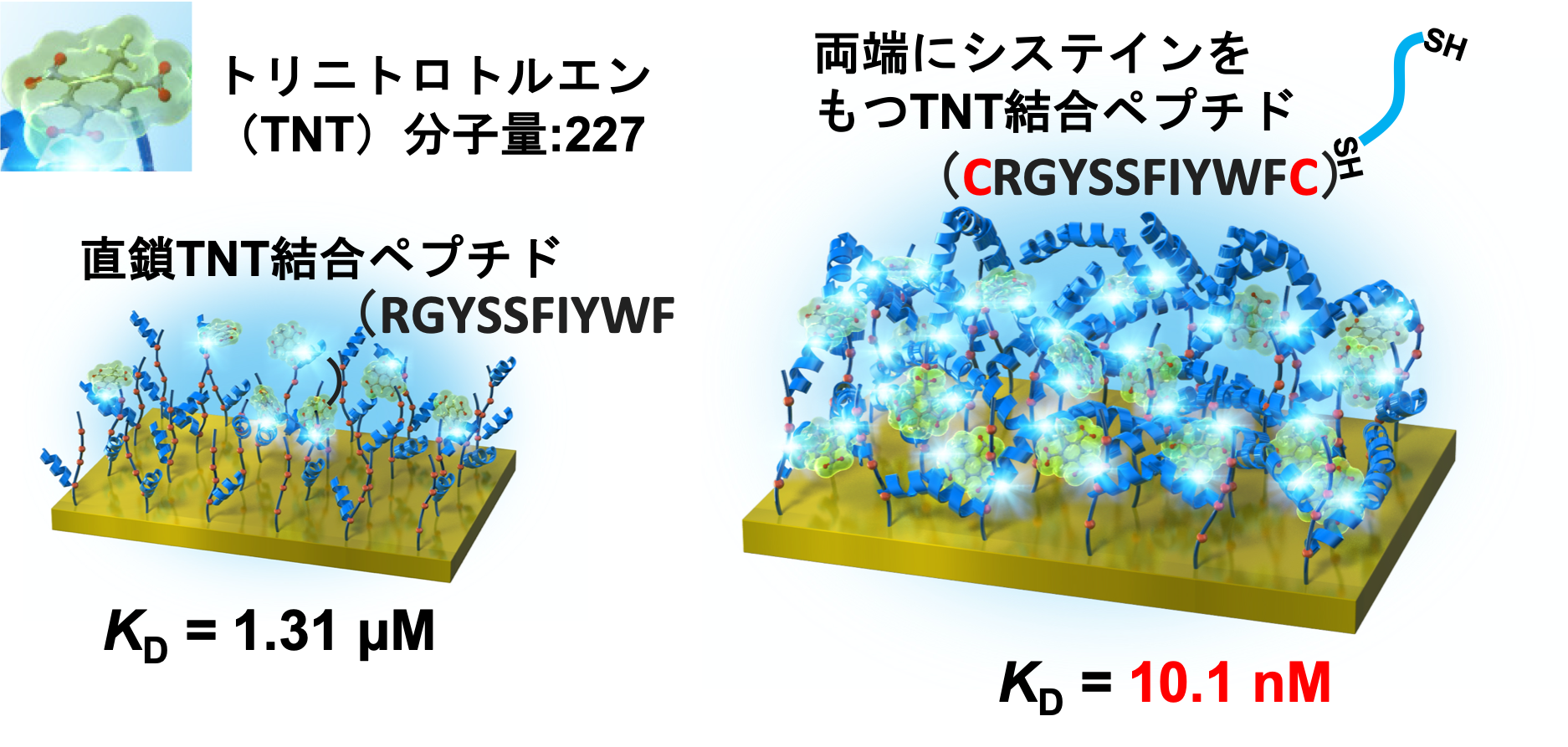
ペプチド分子を用いたバイオセンサー用のプローブ材料の開発を進めています。多数のペプチド候補ペプチドを同時に合成できるペプチドアレイ技術を使うことで、対象とする物質に特異性をもつペプチド配列を探し出すことができます。また、対象がTNT(2,4,6-トリニトロトルエン)のような小分子の場合には、直鎖状ペプチドでは結合力が十分ではない場合がありましたが、ペプチドの両端にシステイン残基を付加して、センサ表面上で連結させることでできる構造体、ペプチドマトリックスを構築することによって、小分子に対する結合力が抗体に比肩するほど向上することを見出しています。
We are currently developing peptide probes for the development of biosensors. Using peptide array technology, which enables the simultaneous synthesis of several candidate peptides, it is possible to identify peptide sequences that bind with their targets. In the case of small molecules such as 2,4,6-trinitrotoluene (TNT), linear peptides sometimes do not have sufficient binding affinity. Thus, we designed a novel peptide probe. By adding cysteine residues to both ends of a linear TNT-binding peptide, a peptide matrix structure was formed through the linking of each peptide by S-S bonding on the sensor surface. The novel functional surface showed a strong binding ability to small molecules with comparable affinity to antibodies. The probe design technique is simple and will be useful in various biosensor developments in the future.